分析化学2064774 知到智慧树答案2024 z23765
第一章 单元测试
1、
试液体积在1~10 mL的分析称为( )
A: 微量分析
B: 半微量分析
C:常量分析
D:痕量分析
答案: 半微量分析
2、
定量分析工作要求测定结果的误差( )
A:越小越好
B:在允许误差范围内
C:最好是正误差
D:接近零
答案: 在允许误差范围内
3、
有一铜矿试样测定其含水量为1.00%,干试样中铜的的质量分数为54.00%,湿试样中铜的质量分数为( )
A:55.00%
B:54.10%
C:53.46%
D:53.00%
答案: 53.46%
4、
对于一组测定数据,平均偏差与标准偏差相比, 更能灵敏的反映较大偏差的是( )
A:标准偏差
B:不确定
C:平均偏差
答案: 标准偏差
5、
某重量法测定Se的溶解损失为1.8 mg Se,如果用此法分析约含18% Se的试样, 当称样量为0.400 g时, 测定的相对误差是( )
A:-1.8%
B:2.5%
C:1.8%
D:-2.5%
答案: -2.5%
6、
判断下列情况,造成偶然误差的是( )
A:以含量为98%的金属锌作为基准物质标定EDTA溶液的浓度
B:读取滴定管读数时,最后一位数字估测不准
C:称量过程中,天平零点略有变动
D:蒸馏水中含有微量被测物质
答案: 读取滴定管读数时,最后一位数字估测不准;称量过程中,天平零点略有变动
7、
下列有关随机误差的正确论述是( )
A:随机误差在测定中不可避免
B:随机误差具有重现性
C:随机误差具有单向性,可以通过增加测定次数消除
D:随机误差可以用对照实验消除
答案: 随机误差在测定中不可避免
8、
在下列表述中能提高分析结果准确度的是( )
A:校准所用的仪器
B:做平行实验时称量试样的质量完全一样
C:做空白试验检验试剂纯度
D:选择合适的方法
答案: 校准所用的仪器;做空白试验检验试剂纯度;选择合适的方法
9、
能消除测定方法中的系统误差的措施是( )
A:用标准试样进行对照试验
B:认真细心地做实验
C:增加平行测定次数
D: 称样量在0.2g以上
答案: 用标准试样进行对照试验
10、
下列四个数据中为四位有效数字的是( )
A:0.0056
B:pH=11.80
C:0.5006
D:0.05600
答案: 0.5006;0.05600
第二章 单元测试
1、
草酸(H2C2O4)的pKa1和pKa2分别是1.2和4.2。溶液中
[H2C2O4] = [C2O42-]时pH 为( )
A:
4.2
B:
2.7
C:
1.2
D:
3.2
答案:
2.7
2、
0.020 mol·L-1 NaOH溶液的pH为( )
A:
13.30
B:
11.20
C:
13.00
D:
12.30
答案:
12.30
3、
在滴定分析中,对其化学反应的主要要求是( )
A:滴定剂必须是基准物质
B:反应必须有颜色变化
C:滴定剂与被测物质必须是1:1反应
D:反应必须定量完成
答案: 反应必须定量完成
4、
下列叙述 Na2S溶液的质子条件,正确的是( )
A:
[H+]+[HS–] +[H2S]=[OH–]
B:
[H+]+[Na+]= [HS–]+2[S2-] +[OH–]
C:
[H+]+[Na+]= [HS–]+[S2-] +[OH–]
D:
[H+]+[HS–] +2[H2S]=[OH–]
答案:
[H+]+[HS–] +2[H2S]=[OH–]
5、
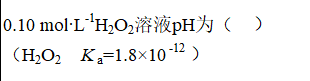
A:
6.74
B:
7
C:
6.36
D:
1.00
答案:
6.36
6、
甲基橙(pKa=3.4)的变色范围为3.1~4.4,若用0.1 mol·L-1 NaOH滴定0.1 mol·L-1 HCl,则刚看到混合色时,[In–]/[HIn]的比值为( )
A:
1.0
B:
2.0
C:
10.0
D:
0.5
答案:
0.5
7、
酸碱滴定总选择强酸(碱)作滴定剂理由是( )
A:配制方便
B: 指示剂变色范围大
C: 反应速度快
D:滴定突跃范围大
答案: 滴定突跃范围大
8、
用0.1000 mol·L-1 NaOH溶液滴定0.1000 mol·L-1HAc和0.1000 mol·L-1 NH4Cl混合溶液中的HAc,化学计量点时的pH为( )(已知NH3 Kb=1.8×10-5,HAc Ka=1.8×10-5)
A:
6.80
B:
7.20
C:
7.00
D:
8.72
答案:
7.00
9、
Na2B4O7·10H2O作为基准物质用来标定HCl,若将其置于干燥器中保存,则所标定的HCl浓度( )
A:
偏高
B:
偏低
C:
无法预测
D:
无影响
答案:
偏低
10、
用甲醛法测定铵盐中含氮量满足式( )
A:
n(N) = 1/4n(NaOH)
B:
n(N) = 4n(NaOH)
C:
n(N) = n(NaOH)
D:
n(N) = 3n(NaOH)
答案:
n(N) = n(NaOH)
第三章 单元测试
1、
植物进行光合作用的主要色素是叶绿素,它是( )离子的络合物。
A:铝
B:铁
C:镁
D:钙
答案: 镁
2、
将2×10-2mol·L-1 NaF溶液与2×10-4mol·L-1 Fe3+溶液等体积混合, 并调pH为1.0。此时铁的主要存在形式是( )。[已知Fe-F络合物的lgβ1-lgβ3分别是5.3, 9.3, 12.1, pKa(HF)=3.2]
A:
FeF2+
B:
FeF3
C:
Fe3+
D:Fe
答案:
FeF2+
3、
叙述Na2H2Y溶液以Y4-形式存在的分布系数[δ(Y4-)]时,说法正确的是 ( )。
A:
δ(Y4-)与pH的大小无关
B:
δ(Y4-)随pH的增大而增大
C:
δ(Y4-)随pH的增大而减小
D:
δ(Y4-)随酸度的增大而增大
答案:
δ(Y4-)随pH的增大而增大
4、
用EDTA滴定金属M, 若M分别与A,B,C三种络合剂发生副反应,此时计算M的公式是( )。
A:αM =αM(A)+αM(B)+αM(C)-3
B:αM =αM(A)+αM(B)+αM(C)-1
C:αM =αM(A)+αM(B)+αM(C)-2
D:αM =αM(A)+αM(B)+αM(C)
答案: αM =αM(A)+αM(B)+αM(C)-2
5、
今有a、b浓度相同的Zn2+-EDTA溶液两份:a为pH = 10.0的NaOH溶液;b为pH = 10.0的氨性缓冲溶液。则在a、b溶液中Zn2+-EDTA的KZnY值的大小是( )。
A:
a溶液的KZnY和b溶液的 KZnY相等
B:
a溶液的KZnY比b溶液的KZnY大
C:
a溶液的KZnY比b溶液的KZnY小
D:
无法确定
答案:
a溶液的KZnY比b溶液的KZnY大
6、
已知PAR指示剂的H2In和HIn–形式显黄色,In2-形式及其金属离子络合物均为红色,PAR的pKa2 = 12.4。据此判断,PAR在pH < 12时,呈 ( )色。
A:
红
B:
不确定
C:
黄
D:
橙
答案:
黄
7、
在一定酸度范围内,酸度越小EDTA与金属离子形成配合物的条件稳定常数K’MY( )。
A:
越小
B:
越大
C:
不确定
D:
不变
答案:
越大
8、
在金属离子M和N等浓度的混合液中, 以HIn为指示剂, 用EDTA标准溶液直接滴定其中的M, 若Et≤0.1%、pM=±0.2,则要求( )
A:
pH=pK’MY
B:
lgKMY-lgKNY≥6
C:
NIn与HIn的颜色应有明显的差别
D:
K’MY < K’MIn
答案:
lgKMY-lgKNY≥6
9、
pAN指示剂易发生( ),可以通过加入有机溶剂或加热的方法加以解决。
A:僵化现象
B:氧化现象
C:封闭现象
D:沉淀现象
答案: 僵化现象
10、
EDTA滴定Al3+、Zn2+、Pb2+混合液中的Al3+应采用( )。
A:
直接滴定法
B:
置换滴定法
C:
间接法
D:
回滴法
答案:
置换滴定法
第四章 单元测试
1、
在 1mol·L-1 HCl溶液中, φθ'(Cr2O72-/Cr3+) = 1.00 V。用固体亚铁盐将0.100 mol·L-1 K2Cr2O7溶液还原至一半时的电位是( )。
A:
1.01V
B:
1.00V
C:
0.70V
D:
1.04V
答案:
1.01V
2、
MnO4–滴定 Fe2+时, Cl–的氧化被加快是由于发生了( ) 。
A:副反应
B:诱导反应
C: 催化反应
D:自动催化反应
答案: 诱导反应
3、
Fe3+ 与 Sn2+反应的平衡常数对数值(lgK)为( )
( φθ(Fe3+/Fe2+)= 0.77 V, φθ(Sn4+/Sn2+)= 0.15 V) 。
A:
2×(0.15-0.77)/0.059
B:
2×(0.77-0.15)/0.059
C:
3×(0.77-0.15)/0.059
D:
(0.77-0.15)/0.059
答案:
2×(0.77-0.15)/0.059
4、
0.05 mol·L-1 SnCl2溶液 10 mL 与 0.10 mol·L-1 FeCl3溶液 20 mL 相混合,平衡时体系的电位是 ( )。
[已知此条件时 φθ'(Fe3+/Fe2+)= 0.68 V,
φθ' (Sn4+/Sn2+)= 0.14 V] 。
A:
0.50V
B:
0.68V
C:
0.14V
D:
0.32V
答案:
0.68V
5、
1 mol·L-1 H2SO4介质中用Ce4+滴定Fe2+,化学计量点时的电位φsp =( )。
[ φθ' (In) =0.85V, φθ' (Fe3+/Fe2+)=0.68V,
φθ'(Ce4+/Ce3+)=1.44V]
A:
0.68V
B:
0.85V
C:
1.44V
D:
1.06V
答案:
1.06V
6、
在酸性溶液中,为了使0.2000 g纯Na2C2O4被完全氧化,需KMnO4溶液31.00 mL。若以碘量法滴定该KMnO4溶液25.00 mL,需0.1000 mol·L-1 Na2S2O3标准溶液( )毫升?
[ M(Na2C2O4) = 134.0 ]
A:
12.04
B:
48.15
C:
24.073
D:
24.08
答案:
24.08
7、
用K2Cr2O7滴定 Fe2+, 在化学计量点时, 有关离子浓度的关系是 ( )
A:
[Fe3+] = 3[Cr3+], [Fe2+] = 6[Cr2O72-]
B:
3[Fe3+] =[Cr3+], [Fe2+] = 6[Cr2O72-]
C:
[Fe3+] = 3[Cr3+], 6[Fe2+] = [Cr2O72-]
D:
[Fe3+] =[Cr3+], [Fe2+] = [Cr2O72-]
答案:
[Fe3+] = 3[Cr3+], [Fe2+] = 6[Cr2O72-]
8、
使Na2S2O3溶液不稳定的因素是( )。
A:
水中的微生物
B:
水中溶解的CO2
C:
Na2CO3
D:
水中溶解的O2
答案:
水中的微生物
;
水中溶解的CO2
;
水中溶解的O2
9、
高锰酸钾法测过氧化氢所使用的指示剂是( )。
A:
酚酞
B:
淀粉溶液
C:
二苯胺磺酸钠
D:
高锰酸钾
答案:
高锰酸钾
10、
97.31mL 0.05480 mol·L-1 I2溶液和97.27mL 0.1098 mol·L-1Na2S2O3溶液混合,加几滴淀粉溶液,混合液呈现( )。
A:
红色
B:
无色
C:
红棕色
D:
蓝色
答案:
无色
下方是付费阅读内容:本平台商品均为虚拟商品,无法用作二次销售,不支持退换货,请在购买前确认您需要购买的资料准确无误后再购买,望知悉!
完整答案需点击上方按钮支付5元购买,所有答案均为章节测试答案,无期末答案。购买后上方矩形框将出现已付费的隐藏内容。
点关注,不迷路,微信扫一扫下方二维码
关注我们的公众号:阿布查查 随时查看答案,网课轻松过

为了方便下次阅读,建议在浏览器添加书签收藏本网页
电脑浏览器添加/查看书签方法
1.按键盘的ctrl键+D键,收藏本页面

2.下次如何查看收藏的网页?
点击浏览器右上角-【工具】或者【收藏夹】查看收藏的网页

手机浏览器添加/查看书签方法
一、百度APP添加/查看书签方法
1.点击底部五角星收藏本网页

2.下次如何查看收藏的网页?
点击右上角【┇】-再点击【收藏中心】查看

二、其他手机浏览器添加/查看书签方法
1.点击【设置】-【添加书签】收藏本网页

2.下次如何查看收藏的网页?
点击【设置】-【书签/历史】查看收藏的网页

